タンパクを形成するペプチド結合でアミノ酸からタンパクになる過程の第一段階のペプチド結合の話を書いた。
ペプチド結合の段階だとポリペプチドと呼ばれ、まだタンパクとしての機能はない。
この後、アミノ酸の直鎖が折りたたまれることによって、ここのアミノ酸の働きの組み合わせで酵素のような複雑な機能を持ち始める。
折りたたみには二次構造、三次構造とあるが、それらの細かい話はなしにして、折りたたみの際にいくつかの結合を行うが、今回はそれを見ていこうと思う。
例えば、アミノ酸が直鎖になっているものを一本の線に見立てたとして、

折りたたむというのを上の図の様にした場合、この折りたたみを永続的にしたい場合は、
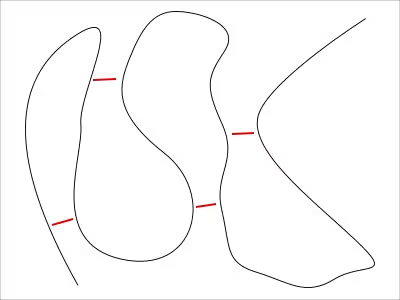
折りたたまれたことによってできた、直鎖が接近した箇所で何らかの結合を行えば良い。
単純に考えて、この結合が多ければ多い程、強度のあるタンパクになると考えられる。
更に、この結合で、結合力の強い結合方法を採用すればする程、なかなか分解しにくいタンパクになりそうだ。
結合数に関しては、ここのタンパク毎によってそれぞれなので、これ以上は触れないとして、結合の方法はいくつかあるので、それを見ていきたいと思う。
結合にはいくつかのパターンがあって、弱く結合する非共有結合のイオン結合、水素結合、ファンデルワールスや疎水結合がある。
ここらへんは今回の話題にはないので省略
強く結合する共有結合のジスルフィド結合がある。
ジスルフィドは読んで字の如く、ニ個(ジ)の硫黄(スルフィド)原子がつながったもので、硫黄間の共有結合なので安定なつながり方になる。
実際、どんな結合かというと、
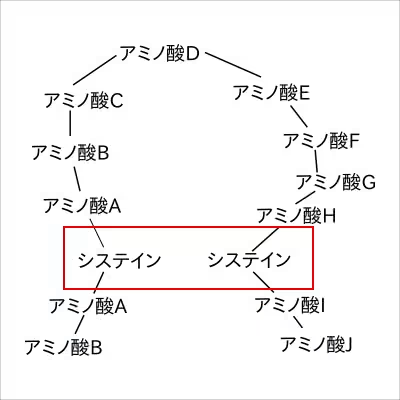
(アミノ酸A〜Jには数あるアミノ酸のどれかが入る)
こんな感じで、アミノ酸が直鎖につながって、折りたたみが開始された時、システイン同士が向い合って並ぶ結合のことを指す。
実際にどんな結合の話に入る前にシステインがどんなアミノ酸かというと、
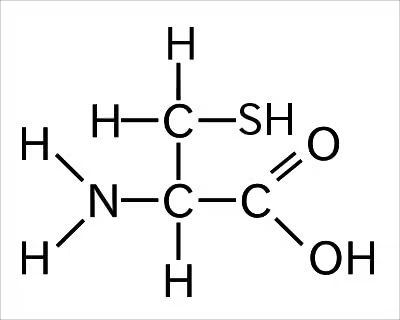
アミノ酸の基本構造のR基にCH2SH(メタンチオール)がついたもの。

このシステインのSH(チオール基)が対面して、
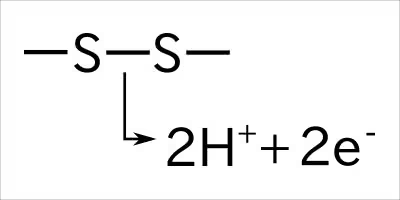
酸化反応により、硫黄間で共有結合が発生する。
上で詳細は省いたけど、この結合は他の非共有結合よりも安定で熱にも強くなる。
(タンパクは熱で変性して、機能消失するという特徴がある)
つまりは、ジスルフィド結合が多ければ多い程、分解されにくいタンパクになるということね。
余談だけど、人体でジスルフィド結合が多いタンパクは毛と爪でどちらも分解されにくい。