前回のボルタ電池の記事でボルタ電池について触れた。
ボルタ電池について、Wikipediaの記述を読むと、
/*****************************************************/
正極に銅板を、負極には亜鉛板を用いる。電解液には硫酸を用いる。負極の亜鉛は、硫酸に含まれる水素イオンより金属のイオン化傾向が大きいため電子を失って2価の陽イオンとなる (Zn2+)。電子は導線を伝わって銅板に流れ、水素イオン (2H+) と反応して水素 (H2) となって放出される。この酸化還元反応は本来発熱反応であり、そのエネルギーを電子の流れにして電気エネルギーに変換したのがボルタ電池である。
/*****************************************************/
という記述がある。
ボルタ電池では酸化還元反応は本来は発熱反応であるところを電気エネルギーに変換したものだとされ、このエネルギーの尺度に酸化還元電位(Eh)を用いる(?)。
酸化還元電位という用語だけれども、最近の肥料の話題でも時々見かける。

土壌の酸化還元電位が高い場合は土壌の生物多様性は低く病気が発生しやすいが、酸化還元電位が低い液肥を散布することで一時的に土壌の酸化還元電位を下げて病気の発生率を減らすといったニュアンスで記載されている。
であれば、今眼の前にある酸化還元電位という用語の理解を深めれば、秀品率の向上に繋がるかもしれないので、挑戦してみることにする。

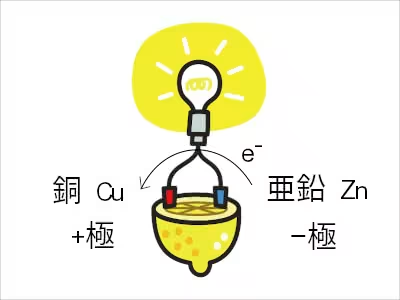
はじめに上の図で電気が発生した理由について考えてみる。
ボルタ電池では酸、銅と亜鉛を用いたが、金属の箇所は各々にある標準電極電位に差があれば良いらしい。
各々の標準電極電位については標準電極電位 - Wikipedia#代表的な標準電極電位を見てもらうとして、今挙がっている三種の標準電極電位のみをピックアップすると、
亜鉛 Zn : -0.763V
酸 H:0V
銅 Cu:0.340V
になっている。
数字が0より小さいものがイオン化しやすく、酸化されやすい。
酸化は自身の電子が奪われ、周辺のものに電子を与え還元することである。
数字が0よりも大きい場合は還元されやすい。
つまりは電子を得るという事になる。

再び上の図を見ると、Cu - H - Znのように標準電極電位が左から右に向かって数字が小さくなるように配置すると、
Zn → Zn2+ + 2e-
のように亜鉛が酸化され電子を放出しながらイオン化する。
放出された電子は導線を通って、標準電極電位の高い銅に向かう。
銅側のプラス極では、
CuO + 2H+ + 2e- → Cu + H2O
電子を受け取る反応が生じている。
亜鉛から銅に電子が移動する事が電流であって、移動する強さ(速さ?)が電圧になるわけだから、上記の反応は電池として成り立っている。
酸化還元電位の差が大きい程、電子の移動が速くなるので電圧が高くなるという理解で良いのかな。
現時点では今回の話が土壌に適用できる段階には辿り着いていない。
酸化還元電位を下げれば、土壌中の鉄が還元されニ価鉄が増える。
このニ価鉄が植物に吸収され、植物の勢いが増すということは想像できる。
土壌中のニ価鉄が増えれば、リン酸鉄由来の可溶性リン酸もきっと増えるはず。
完熟した家畜糞を与えると酸化剤のように働く硝酸態窒素を大量に投入してしまうため、酸化還元電位を上げ、土壌中のニ価鉄の状態の鉄が減り、作物が弱るということも想像できる。
肥料を散布することで一時的に酸化還元電位を下げるという事のイメージは現時点では難しい。
関連記事
農薬や化学肥料を使用して栽培すると野菜が育たない環境になるという意見に対して4