腐植の形成で頻繁に目に付く求核置換反応とは?の記事で腐植の形成で重要になるであろう求核置換反応について触れた。
前回の記事では、
CH3-Cl + NaOH → CH3-OH + NaCl
の反応について見て、OH-(水酸化物イオン)が非常に強力な求核剤であるそうだ。
中和反応としての水酸化物イオンとごっちゃになっていて、いまいちイメージが掴めないので、求核剤としての水酸化物イオンについて見ていくことにする。
水酸化物イオンが求核剤としての特徴があるのは、下記の二点に因るものらしい。
1つ目が、酸素原子に非共有電子対が2つ存在しており、電子が豊富にある。
この電子対を他の原子に提供することで、新しい結合を形成しようとする性質があるそうだ。
2つ目が、負電荷を帯びているため、電子を求めている正電荷を持つ原子や部分正電荷を持つ原子に引き寄せる。
1つ目の非共有電子対が重要であるので、図で可視化してみると、
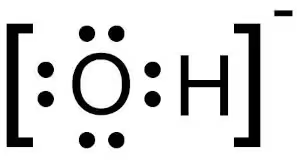
酸素の方に電子対(●が2つ)が4個あり、そのうち3個には水素が付いていない非共有電子対がある。
3個の非共有電子対が強力な酸化剤の要因となるそうだ。
あとは、電子を求めている正電荷を持つ原子というものが何であるか?がわかれば、求核置換反応のイメージが膨らむようになるのかな。