硫酸アンモニウム(硫安)がなぜ生理的酸性肥料なのか?という話になった。
一般的な話としては、硫酸は強酸、アンモニウムイオンは弱塩基で、強酸と弱塩基の塩は酸性を示すという話がある。
水に溶けたとき、弱塩基の陽イオンが加水分解をした時に酸性を示すからだそうだ。
詳しくは、[NH4]2SO4が2NH4+ + SO4-に分かれるわけだけど、ここで発生したアンモニウムイオンが、NH4+ + H2O → NH3 + H3O+になって、残りは硫酸イオンで水素イオンを受け取って強酸だから、アンモニアと硫酸を比較して酸性でしょ?
という話になる。
ちょい戻って、アンモニウムイオンが植物に吸収されるから、均衡をとって酸性になるという話がある。
[NH4]2SO4 → 2NH4+ + SO4-
ここね。
2NH4+が植物に吸収されることによって、SO4-が土壌に残り、このSO4-が土壌の均衡を得るために、
SO4- + 2H2O → H2SO4 + 2OH-
になって、新たに発生した水酸化物イオンが、土壌鉱物から水酸化アルミニウムみたいな水酸化物の金属になって、残った硫酸イオンが土壌金属を遊離しちゃったよ。
ということになる。
でも、この話だと違和感がある。
だって、
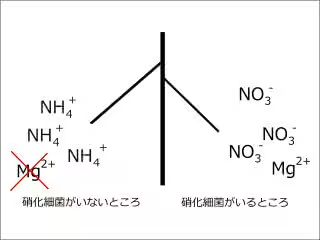
以前、アンモニウムイオンがマグネシウムと拮抗するから、なるべくアンモニウムイオンは硝酸イオンにしておいた方が良いよ。
※ただし畑作に限る
という話があって、これはアンモニウムイオンがCECに吸着しているから起こることで、CEC周りですでに化学的な均衡がとれているんじゃないの?って思えてしまう。
書いていて何となくだけど、アンモニウムイオンがCECに付く時に、CECについていた水素イオンを硫酸に渡して、これで硫酸が発生したね。
ということになるのかなと?
最近、いろんな人と肥料の話をしてみて、この手の結合周りが弱いなと自覚し始めた。
農学部農学科では、こういうことをやる機会が無かったからな。
日本の栽培に関して、最重要事項なはずなのにな…
とりあえず、冒頭の強酸と弱塩基からなる塩は酸性ということだけ覚えておくだけでも幾分変わる。
関連記事