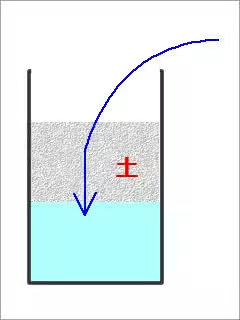
土を上の画像の様な感じで配置して、その土を濾過槽として使う。
上からpHが低い水を流し込むと、下の水は中性に近い値になるらしい。
pHが高い場合でも中性に近い値になるらしい。
つまるところ、土にはpHを中性付近にする緩衝性があることが分かる
これはく溶性の炭酸石灰や炭酸苦土といった炭酸塩が、土壌中のpHの低い水に触れて中和される。
それだと、pHが高い水だった場合はどうなるの?って話になるよね。
そこでこんな話がある。
これからの話はあくまで教科書レベルであって、実際にそういう風に動くかはわからない。
それを踏まえた上で、
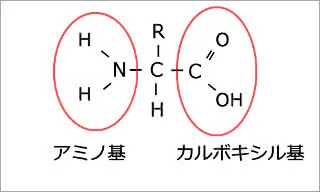
アミノ酸という有機酸がある。
アミノ酸はアミノ基、カルボキシル基、あとはたくさん種類のあるアミノ酸毎に異なるRという構成でできていて、
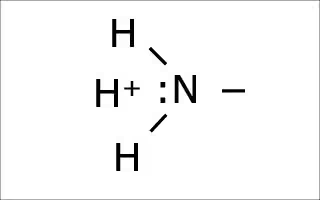
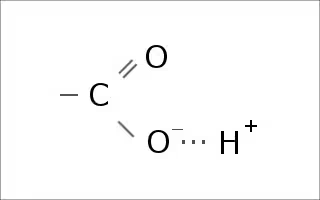
どちらも水素イオン(H+)を保持することができる。
このような二つ以上の基をもつ化合物は周囲のpHの変動に対して素敵な反応をする。
周囲のpHが高い時、すなわちH+が少ない時は、

アミノ基に付いたH+を放出する。
逆に周囲のpHが低い場合、つまりはH+が多い場合は、アミノ基がH+を受け取る。
アミノ酸等のもつこのような特徴を等電点と呼び、
(実際の等電点の意味は違うけど、そこはご愛嬌で)
等電点のある化合物を溜め込むと、周囲のpHがなかなか変化しない緩衝性を得られることになる。
因みに、等電点のある化合物を多く含むものとして、

腐植がある。
となると、腐植は保肥力と緩衝性を同時に得られると言うことになる。