腐植酸とは何なのか?1の記事で、腐植酸の定義を整理した後に、腐植酸の一種であるフミン酸とフルボ酸が酸性の溶液に溶ける理由について触れた。
今回はアルカリ性溶液に溶ける理由について考えていこう。
フルボ酸のような(おそらく)大きな化合物が水に溶けるというのは下記の段階を踏んで考えるそうだ。
陰イオン化
フルボ酸のカルボキシル基やフェノール性ヒドロキシル基は、この水酸化物イオンと反応し、水素イオンを放出して陰イオンになる。
静電気的反発
フルボ酸が陰イオンになると、同じく負の電荷を持つ他のフルボ酸分子との間で静電気的な反発力が働く。
この反発力により、フルボ酸分子同士が離れやすくなり、水中に分散しやすくなる。
水和作用
水分子は極性を持っているため、陰イオン化したフルボ酸分子を包み込む。
この水和作用によって、フルボ酸分子は水中に安定に存在できるようになる。
最初の陰イオン化について整理すると、フルボ酸のイメージがしやすくなるので、丁寧に見ていくことにする。
逆順になるがフェノール性ヒドロキシ基というのは、
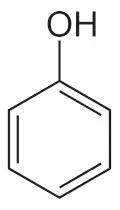
になる。
エタノール等の炭素鎖の末端にヒドロキシ基(-OH)が付与されたアルコールの場合は、ヒドロキシ基のOからHが離れないが、ベンゼン環(六角形の個所)に付与されたヒドロキシ基(-OH)は
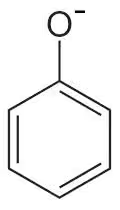
のようにH+が外れる。
この反応が陰イオン化になる。
自信はないが、
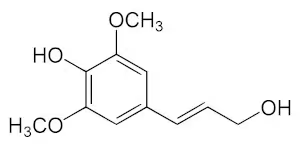
リグニンの基となるモノリグノールより、
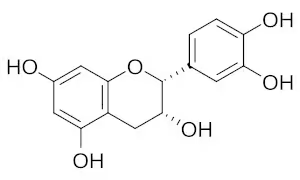
縮合型タンニンの基となるポリフェノールの方が、陰イオン化になる傾向が強いはず。
もう一つのカルボキシル基(-COOH)だけれども、モノリグノールとポリフェノールのどちらもカルボキシ基を持たない。
であれば、カルボキシ基はどこからやってくるのだろう?
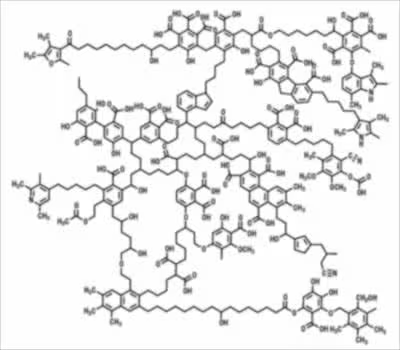
図:藤嶽暢英 土・水環境に遍在するフミン物質の構造化学的特徴とその多様性 学術の動向 2016.2 51ページより抜粋
上のフミン酸のモデルを眺めてみると、所々に
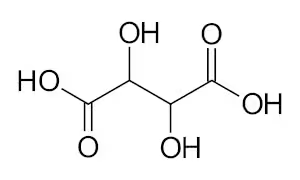
JaGa - self-made using BKChem and Inkscape, CC 表示-継承 3.0, リンクによる
酒石酸らしきカルボン酸や、それ以上の炭素数のカルボン酸がフェノール性化合物の間に入り込んでいるように見える。
おそらくこれらの組み込まれたカルボン酸がアルカリ性溶液に溶ける要因となるのだろう。
腐植酸とは何なのか?1の記事で分類した腐植酸のうち、酸性溶液とアルカリ性溶液のどちらにも溶けるフルボ酸が栽培者にとって一番欲しい腐植酸であるはずで、これはポリフェノールやモノリグノール由来の腐植物質にカルボン酸がたくさん付与したものであると捉えるならば、堆肥作りで何を配合すれば良いのか?が予想しやすくなる。
酒石酸のような炭素鎖の両端にカルボキシ基が付与されているようなカルボン酸はどこに多く含まれているのだろうか?
※カルボキシ基が2つ付いているカルボン酸をジカルボン酸と呼ぶらしい。
それがわかったら、良質な堆肥の製造が捗るかもしれない。