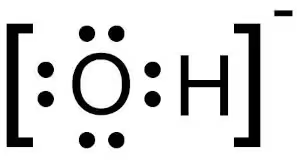
求核剤について1の記事で、求核剤としての水酸化物イオンについて触れた。
水酸化物イオンが非共有電子対を多く持つ負電荷のイオンであることが強力な求核剤としての条件であるならば、腐植の形成で頻繁に目に付く求核置換反応とは?の記事で触れた
CH3-Cl + NaOH → CH3-OH + NaCl
の反応式で気になることがある。
それは、

塩素イオンも非共有電子対をたくさん持つ負電荷のイオンであるため、これも強力な求核剤であるはずだ。
というわけで、求核剤について更に整理してみることにする。
水酸化物イオンと塩素イオンの比較について検索をしてみると、
| イオン | 電子密度 | 原子半径 | 求核性 |
|---|---|---|---|
| Cl- | 高い | 大きい | 中程度 |
| OH- | より高い | より小さい | より強い |
※上記表は生成AIのGeminiが作成
という内容があった。
電子密度が高い方が求核剤としての強さを高めるらしく、密度が高くなる要因の一つとして、原子半径が小さいことにあるらしい。
原子半径が小さいということは、
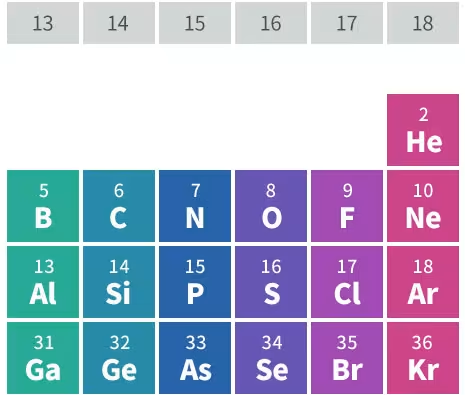
元素周期表の並び順を確認すればわかる。
17の塩素(Cl)より、8の酸素(O)の方が小さく、水酸化物イオンのHは非常に小さい。(というか考えない)
※Oの電気陰性度がClより高いということも重要
これから腐植の形成を考える上で、様々な求核剤を見ていくことになるだろうが、今回触れたような内容を一つの指針として見ていくことにしよう。