アミノ酸の復習がてら、等電点について触れておく。
等電点については以前記載したけれども、定義から再確認してみる。
はじめにアミノ酸の定義を見てみると、一つの分子の中に、酸性を呈する基と塩基性を呈する基の双方が存在する化合物のことをアミノ酸という。
アミノ酸 タンパク質と生命活動の化学 - 東京電機大学出版局の1ページ目より引用
この定義を図で見てみると、
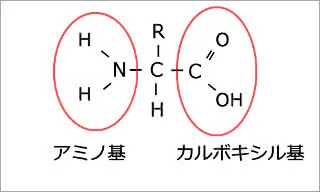
右にあるカルボキシ(ル)基(-COOH)が酸性を呈し、左にあるアミノ基(-NH2)が塩基性を呈す。
具体的には
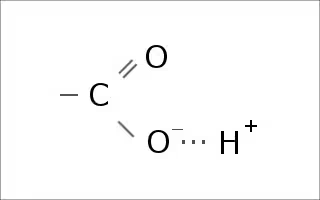
カルボキ(シ)基のHが外れて、周辺の環境のpHを下げ、
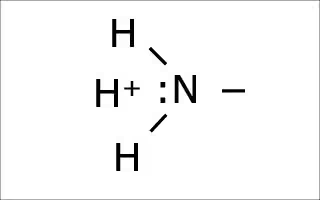
左側のアミノ基の窒素の特徴で、水素イオンを余分に持てることで周辺の環境のpHを上げる。
アミノ酸をある溶液中に溶かすと、酸性と塩基性の両方の基を持つため、
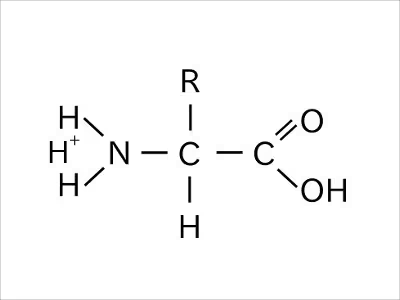
酸性環境下では、カルボキシ基とアミノ基の両方に水素イオンを持った状態となり、
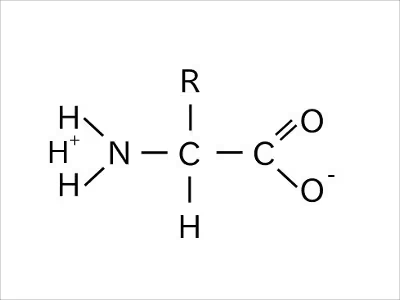
中性環境下では、カルボキシ基から水素イオンが離れ、
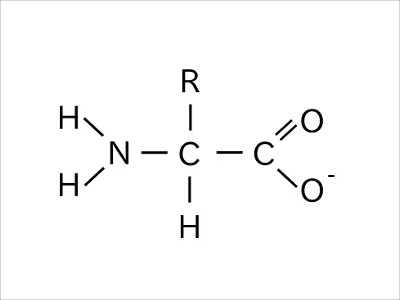
塩基性環境下では、どちらの基からも水素イオンが外れた状態となる。
環境によって水素イオンを受け取ったり離したりできるので、周辺の環境のpHは変動しにくくなる。
ここで等電点を挙げると、電離後(水に溶けた後)の化合物全体の電荷平均が0となるpHのことを指すので、

水に溶けたアミノ酸が上記のようなプラス(左)とマイナス(右)を持つような状態になるためのpHのことを等電点と指す。
等電点で一つ例を挙げておくと、側鎖が-Hのグリシンでは等電点は5.97となっている。
等電点について、他にも重要な要素はいくつかあるけれども、それはここでは触れないでおく。
とりあえず、アミノ酸には酸性を呈する基と塩基性を呈する基が共存していることを記載したかった。
関連記事