キレート結合で重要な配位結合について見るの記事でキレート結合で重要となる配位結合(共有結合の一種)を見たので、この内容を元にキレート結合について見る。
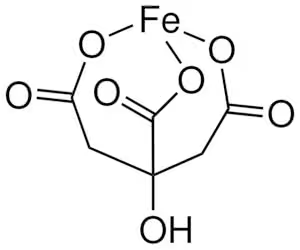
※図:クエン酸鉄(III) technical grade | Sigma-Aldrichより引用
クエン酸鉄を例題にして話を進める。
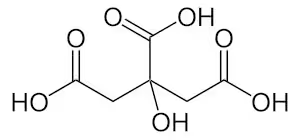
クエン酸鉄はクエン酸が持つ3個のカルボキシ基(-COOH)の箇所が鉄(Fe2+かFe3+)を指で摘むように結合している。
この時、どのように結合しているのか?を考えてみる。
クエン酸のカルボキシ基が鉄(Fe)を摘んでいる箇所は酸素(O)の箇所になる。
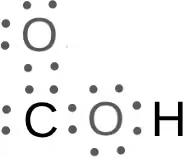
電子式で書くとこんな感じだろうか。
※左上の酸素(O)の非共有電子対の位置は自信はない。
ここで注目すべきはCOHの箇所で、非共有電子対が2個ある。
この2個の非共有電子対の箇所で配位結合ができる可能性がある。
鉄(Fe2+とFe3+)はどちらも陽イオンであるため、電子式で示すと周りに電子がないことになっている。
詳しい話は現時点では端折るが、鉄イオンはFe2+とFe3+のどちらも位置イオンあたり6個の配位結合を行えるそうだ。
※ この6個の配位結合を行える箇所を数えたものを配位数と呼ぶ。
上記の内容を踏まえた上で、クエン酸鉄を改めて見てみると、

※図:クエン酸鉄(III) technical grade | Sigma-Aldrichより引用
カルボキシ基にある酸素(O)3個分と鉄が配位結合を行っていることになる。