キレート結合で重要な配位結合を見る前に共有結合を整理するの記事で化学結合の一種の共有結合について見た。
共有結合の知識を基にして、キレート結合で重要となる配位結合(はいいけつごう)について見ることにする。
配位結合の説明で頻繁に見聞きするものとして、アンモニアを水に溶かす反応があるので、今回もアンモニア水で話を進めることにする。
アンモニア(NH3)を水に溶かした時の反応は
NH3 + H2O ⇄ NH4+ + OH-
になり、アンモニウムイオンは陽イオンとなり、アンモニア水のpHはアルカリ性となる。
NH4+はどのようにして出来たのだろう?
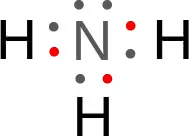
アンモニアは窒素(N)とHの共有結合で成り立っている分子になっている。
上の図で注目すべき箇所として、窒素(N)の上に●が2つあるが、他の原子と結合していない箇所がある。
この箇所を非共有電子対(ひきょうゆうでんしつい)と呼び、ここには興味深い特徴がある。
アンモニアを水に溶かすと、水分子の方がH+とOH-に分かれる。
![]()
H+の方の電子式はHから●を一個手放しているので、●が一つもない状態になる。
このH+はアンモニアで●が2つの非共有電子対と結合する事が出来、
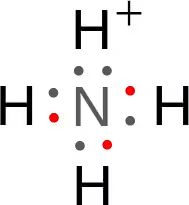
このようになる。
この時のNH3とH+の結合を配位結合(はいいけつごう)と呼ぶ。