クエン酸鉄のキレート結合についての記事で、キレート結合についての理解を深める必要があるという内容を記載して、キレート結合を理解するためには配位結合という化学結合の知識が必要となるという内容を記載した。
配位結合の説明で良く例として挙げられる化合物として、アンモニウムイオン(NH4+)があるのだけれども、アンモニウムイオンに触れる前にアンモニア(NH3)に触れておく必要があり、アンモニアの形成には、共有結合というものが重要になってくるので、今回は共有結合について触れておく。
共有結合とは原子どうしが電子を「共有」して結びつく結合を指す。
これだけでは分かり難いので例を挙げて見てみる。
![]()

上の記述方法は電子式と呼ばれるもので、共有結合に関与する電子の数を表している。
※ Hは水素でNは窒素
●は電子を表し、●が一つの箇所は手のような振る舞いをし、
![]()
このように一つずつの手を共有して繋がり分子を形成する。
この時の結合を共有結合と呼ぶ。
では、もう一つの例として挙げている窒素(N)の方の共有結合を見てみることにすると、

のようになる。
Nで●が一つの箇所が三箇所あり、それらが全て共有結合をしている。
※ ●の数が多い共有結合程強い結合となる
ここで注目すべき点として、最初から●が二個合った場所はそのまま残り、この箇所を非共有電子対(ひきょうゆうでんしつい)と呼ぶ。
今までの例では、同じ原子間での結合であったが、違う原子間でも結合する。
例えば、水素(H)と窒素(N)だけれども、
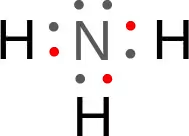
のように共有結合し、上の化合物をアンモニア(NH3)と呼ぶ。
補足
酸素(O)の共有結合